 Má kolegyně říká, že nejlépe si lékař zapamatuje nemoc, když se s ní setká u svého pacienta. A má pravdu. V mém případě to platilo i u autoiminitní polyneuropatie při Guillain-Barré syndromu. Jednoho dne k nám přišla rómská pacientka, které se postupně zhoršovala chůze a u které jsme zjistili chabou paraparézu dolních končetin (milí kolegové, pozor, nepřistupujte ke každému Rómovi jako k simulantovi nebo přeháněči). Rád bych na tomto místě uvedl fakta o této nemoci.
Má kolegyně říká, že nejlépe si lékař zapamatuje nemoc, když se s ní setká u svého pacienta. A má pravdu. V mém případě to platilo i u autoiminitní polyneuropatie při Guillain-Barré syndromu. Jednoho dne k nám přišla rómská pacientka, které se postupně zhoršovala chůze a u které jsme zjistili chabou paraparézu dolních končetin (milí kolegové, pozor, nepřistupujte ke každému Rómovi jako k simulantovi nebo přeháněči). Rád bych na tomto místě uvedl fakta o této nemoci.syndrom guillainův-barrého
___
Syndrom Guillainův-Barrého - autoimunitní polyneuropatie
Úvod
Syndrom Guillainův-Barrého (GBS) je eponymum v současné době používané pro skupinu imunitně zprostředkovaných akutních polyneuropatií. Jde o nejčastější akutní, získanou, autoimunitní periferní neuropatii. Udávaná roční incidence velmi kolísá od 0,16 do 4,0/100 000, stoupá ve starším věku (maximum výskytu bývá mezi 50–70 lety) a lehce převažuje postižení mužů v poměru 1,5:1. Onemocnění je heterogenní jak z hlediska klinické manifestace, tak i elektrofyziologických nálezů. Mezi základní obecnou charakteristiku patří akutní začátek s rychlou progresí nejčastěji během 1–2 týdnů, monofázický průběh, proteinocytologická disociace v likvoru a spontánní úprava u většiny nemocných.
Jde o autoimunitní reakci proti periferním nervům a uplatňují se jak buněčné, tak protilátkové imunologické abnormity. Aberantní odpově d ’ B buněk na glykolipidy nebo obdobné sloučeniny zůstává stále klíčem k patogeneze. Uvažuje se rovněž o patogenetické roli antiglykolipidových protilátek, které vznikají prostřednictvím molekulárních mimiker vlivem mikrobiálních oligosacharidů, především určitých řetězců Campylobacter jejuni. Imunitní mechanizmy jsou někdy spouštěny předchozí infekcí nebo jinými vlivy (tab. 1) a GBS jako postinfekční onemocnění se vyskytuje asi u 2/3 pacientů. Předpokládá se patogenetická souvislost mezi předchozí infekcí a imunitním mechanizmem neuropatie.
Nejběžnějším typem je akutní zánětlivá demyelinizační polyneuropatie (AIDP). Jde o multifokální zánětlivé demyelinizační postižení periferních nervů a míšních kořenů, která je charakterizována kromě segmentální demyelinizace různým stupněm lymfocytární infiltrace periferních nervů, především v proximálních a terminálních úsecích. U těžších forem dochází k sekundární axonální degeneraci. Poškození myelinové pochvy je zprostředkováno hlavně T buňkami, protilátkově zprostředkovaná imunitní porucha přispívá k poruše nervových vláken. Je přítomna také porucha hemato-likvorové bariéry, především v oblasti terminálního větvení a kořenů, která zřejmě zodpovídá za průnik bílkovin do likvoru.
Základní princip imunitní reakce: auto reaktivní T buňky rozpoznají specifický antigen, aktivované T buňky mohou přestoupit nervově-cévní bariéru a vniknout do periferního nervového systému. T buňky aktivují makrofágy, dochází k produkci cytokinů, uvolňování toxických mediátorů a rozvoji demyelinizace a axonální poruchy. Obdobně i protilátky mohou překročit nervově-cévní bariéru a přispívají k procesu demyelinizace i axonální lézi.
Vlastní začátek je charakterizován poměrně rychlým rozvojem (během dnů) nejčastěji symetrické slabosti DK, časté jsou současně myalgie (bolesti bývají u 15–50 % pacientů), parestézie nebo i dysestézie. Obvykle dochází k pomalé ascendentní progresi (50–60 %) a šíření příznaků proximálně, na HK a hlavové nervy. N. facialis bývá postižen až v 50 %.
Onemocnění může ale začít i bulbárním syndromem s descendentním šířením. Progrese trvá obvykle dva, maximálně podle kritérií 4 týdny. K maximu postižení dojde během 7 dnů u 35 % nemocných, během 14 dnů u 70% a během 21 dnů u 84 %. Formy onemocnění jsou velmi variabilní. Lehká forma se projeví jen lehkou slabostí v DK, kde převažuje oslabená dorzální flexe nohou nebo slabost stehenního svalstva, u těžké formy může při ascendentní progresi vzniknout až kvadruplegie, mohou být postiženy i kaudální hlavové nervy, což se projeví bulbárním syndromem, oboustrannou lézí n. VII. (diplegia facialis) i dalších hlavových nervů. Nebezpečná je hlavně ventilační insuficience ze slabosti dýchacích svalů. Podle velkých souborů slabost končetin byla ve 100% – proximální převaha u 49 %, distální 27 %, n. facialis postižen u 53 %, pallanestezie u 59 %, hypalgézie u 22%, parestézie u 75 %, postižení sfinkterů u 32 % a postižení okohybných nervů u 13 % (kompletní oftalmoplegie může být ve 3–5 %). Průběh je afebrilní.
Mohou být i projevy autonomní dysfunkce (tachykardie, arytmie, hypertenze, posturální hypotenze), zejména u pacientů s těžkým motorickým deficitem. Nejčastější je hypertenze a anti hypertenziva je třeba podávat s vysokou opatrností. Nemocní jsou zvýšeně senzitivní na antihypertenziva a náhlá iatrogenní hypotenze může být příčinou i náhlé smrti! EKG změny se popisují až v 50 %.
V objektivním nálezu zjistíme kromě areflexie různě vyjádřený motorický deficit s proximální i distální převahou a nepříliš těžké poruchy čití. U těžších forem mohou být i psychické poruchy, klinické projevy léze CNS (mozečkové nebo lehké spastické příznaky) nebo známky demyelinizace na MR mozku.
AMAN často předchází průjmové onemocnění (zvýšené titry protilátek proti Campylobacter jejuni se nacházejí až v 67 %) nebo infekce dýchacích cest (protilátky proti Hemophilus influenzae ve 13 %), distální slabost převažuje nad proximální, hlavové nervy bývají postiženy asi u 25 % nemocných a respirační dysfunkce je méně častá nežli u GBS. Progrese je poměrně rychlá, průměrně 6 dnů a myotatické reflexy mohou být jen sníženy nebo i zachovány. Zlepšení nastává během 1–2 měsíců. IgG protilátky proti GM1 gan gliozidu se nacházejí ve 40–50 %.
Jako samostatné varianty se vyčleňují polyneuritis cranialis s oboustranným postižením n. VII. a minimálním nebo jen subklinickým nálezem na končetinách, někdy s parestéziemi. Motorické postižení a svalová slabost může být omezeno jen na oblast kraniobulbární (faryngo-cerviko-brachiální) nebo DK s obrazem areflektorické paraparézy s bolestí v zádech, která může připomínat míšní lézi nebo postižení kaudy. Existuje i pouze senzitivní postižení a akutní pandysautonomie.
Akutní senzitivní polyneuropatie (dysimunitní) má většinou asymetrický začátek, pozitivní i negativní senzitivní příznaky jsou vždy více a častěji v popředí nežli senzitivní ataxie.
Miller-Fisherův syndrom je další samostatná forma GBS a je charakterizován akutním začátkem trias oftalmoplegie, ataxie a areflexie, ale někdy mohou být postiženy i další hlavové nervy, především kaudální (bulbární syndrom). Může být i smíšený s klasickým GBS se slabostí končetinového, ale i dýchacího svalstva.
U GBS byla popsána přítomnost různých antiglykolipidových protilátek (GM1, GM1b, GD1b, GM2 aj.). Přestože je zatím nelze využít v diagnostice, lze podle nich rozčlenit GBS na další určité subtypy (obr. 6). Anti GM1 byly častěji přítomny u nemocných se známkami předchozí infekce Campylobacter jejuni a axonálních forem (AMSAN, AMAN), kde převažovala distální motorická léze bez postižení hlavových nervů. Protilátky anti GM2 byly častěji přítomny u infekce Cytomegalovirem, senzitivních lézí, s proximální motorickou převahou s postižením hlavových nervů a demyelinizačních forem (AIDP).
Diagnosticky významná je přítomnost anti GQ1b, která byly přítomna u Miller-Fisherova syndromu v některých studiích u více jak 90 % nemocných, ale byla nacházena rovněž u nemocných s GBS, kde byla přítomna oftalmoplegie.
Velkými randomizovanými studiemi byl prokázán efekt dvou typů imunoterapie, které mohou ovlivnit průběh GBS: plazmaferézy a intravenózního imunoglobulinu (IVIG). S léčbou je třeba začít vždy co nejdříve, především u těžších forem, kdy nemocný není schopen samostatné chůze (stupeň 3 podle kvantifikace) nebo má obdobný neurologický deficit a u stavů se zřetelnou progresí. V úvahu bereme i rizikové faktory, které predikují horší prognózu (tab. 3). Vzhledem k jednodušší aplikaci a menším rizikům a vedlejším účinkům se preferuje jako první volna použití IVIG. Jednoznačně preferenční použití IVIG je u typu AMAN.
Doporučená dávka IVIG byla stanovena empiricky a skutečná optimální terapeutická dávka není známa. Ně kteří autoři preferují schéma s rychlejším podáním celé dávky během 2 dnů, především u mladých nemocných s normálními renálními a kardiovaskulárními funkcemi, ale rychlost infuze by neměla překročit 200 ml/hod. Předpokládají, že rychlé dosažení vysoké koncentrace Ig v séru má lepší terapeutický efekt. Naopak jiní autoři preferují pomalejší 5denní schéma pro menší riziko vedlejších účinků. Pomalá rychlost infuze se doporučuje především u starších nemocných a nemocných s kardiovaskulárními poruchami. Vzestup tělesné tekutiny může vést k městnavé srdeční slabosti. Po aplikaci IVIG dochází také k vzestupu sérové viskozity, což může vést k tromboembolickým poruchám. Zvýšené riziko je u nemocných s již preexistujícím zvýšením viskozity (hypergamaglobulinémie nebo hypercholesterolémie).
Schéma s podáváním vyšších dávek pouze během dvou dnů sice vede k rychlejšímu nástupu efektu, ale může být spojeno s větším výskytem vedlejších reakcí i komplikací – především vaskulárních. Většina autorů proto preferuje 5denní schéma. Před aplikací IVIG se doporučuje vyšetřit ledvinné funkce a u nemocných s alergickou anamnézou hodnoty IgA.
Druhým typem imunoterapie je plazmaferéza. Aplikuje se obvykle obden po dobu 7–14 dnů, většinou obden 5–7x. Randomizované studie prokázaly prakticky stejný efekt plazmaferézy i IVIG. Naopak nebyly prokázány lepší efekty při kombinaci obou typů terapie (nejprve plazmaferéza následována IVIG). V některých případech, kde nedojde k efektu, především zastavení progrese po IVIG, se však doporučuje v odstupu 2–3 týdnů aplikovat i plazmaferézu (toto doporučení však nebylo potvrzeno studiemi, jde jen o kazuistická sdělení). Nikdy však neaplikujeme plazmaferézu bezprostředně po léčbě IVIG. Jednak bychom aplikovaný a drahý imunoglobulin z oběhu opět odstranili, jednak pozitivní léčebný efekt IVIG může ještě několik dnů dobíhat po ukončení aplikace. Po infuzi IVIG sérové hladiny IgG stoupají pětinásobně, během dalších 72 hodin klesnou na 50 % a k normálním původním hladinám se vrací během 3–4 týdnů.
Nezbytným doplňkem terapie je symptomatická léčba, především u bolestí.
Podávání samotných kortikoidů není indikováno, jejich účinnost nebyla u GBS nikdy prokázána. V současné době byla ukončena studie o současném podávání IVIG a methylprednisolonu, ale ani tato kombinace nepřináší významně lepší výsledky nežli samotný IVIG.
Asi u 10 % nemocných se mohou ve 2.–3. týdnu vyskytnout relapsy, které někdy vyžadují přeléčení jednotlivou dávkou IVIG nebo plazmaferézou.
Přestože uvedená imunomodulační terapie přinesla značný pokrok do léčby GBS, udává se, že ovlivní příznivě průběh jen u 60 % nemocných (13).
Prognóza je poměrně příznivá, k funkční úpravě dochází asi u 85 % nemocných během 6–12 měsíců. Po těžkých formách. může zůstat i reziduální deficit, rezidua po 1 roce mohou být až u 15 % nemocných. Mortalita se udává 2–5 % v závislosti na kvalitě komplexní péče.
Může být přítomen tremor, senzitivní ataxie i fokální začátek. Oproti GBS se nevyskytují významné předchozí provokační vlivy, i když vzhledem k pomalému rozvoji může být obtížné je identifikovat.
CIDP se může vyskytovat rovněž u dětí. Začátek je často rychlejší a manifestuje se hlavně poruchou chůze.
Asi u 5 % nemocných s CIDP mohou být klinické známky postižení také centrálního nervového systému. Mohou být projevy spasticity, hyperreflexie nebo ataxie, takže se někdy klinický obraz může podobat i roztroušené skleróze mozkomíšní. Asi 20 % nemocných může mít abnormity pouze zjištěné na MR mozku.
Pro diagnózu je stěžejní elektrodiagnostické vyšetření, které by mělo splňovat daná kritéria pro demyelinizační postižení (viz tab. 5). Pro dia gnózu CIDP by měla být přítomna 3 ze 4 daných kritérií.
Někteří autoři však doporučují i „měkčí“ kritéria, kterými sice mohou zachytit více nemocných, ale jejich specificita se tím snižuje:
Alespoň dva abnormní parametry na dvou nervech:
1. snížení rychlosti vedení motorických vláken ve dvou nebo více nervech (< 90 % dolního limitu pokud amplituda CMAP > 50 % dolní normy, ev. < 80 % pokud amplituda CMAP < 50 %)
2. prodloužená DML na 2 nebo více nervech (>115 % horního limitu normy je-li amplituda CMAP normální, nebo > 125 % je-li amplituda CMAP menší nežli dolní limit)
3. částečný blok vedení nebo časová disperze na jednom nebo více motorických nervech je definován jako poměr proximální a distální amplitudy CMAP < 0,7
4. absence nebo prodloužení latence F vlny alespoň na dvou nervech (> 125 % horního limitu normy)
V likvoru bývá obdobně jako u GBS proteinocytologická disociace. Na MR se mohou někdy prokázat známky ztluštění míšních kořenů (obr. 7). Zobrazovací metody však nepřispívají k diagnostice, jejich role jen při případné dif. dg.
Biopticky se prokázaly jednak známky demyelinizace, jednak intersticiální a perivaskulární a endoneurální infiltrace lymfocyty a makrofágy.
Průběh je asi v 50 % postupně progredující, ve 33 % recidivující (s relapsy a remisemi) a u zbývající části monofázický se stacionárním stavem (bez další progrese). Formy s akutním začátkem se prakticky nedají odlišit od GBS, rozlišení přinese až další průběh.
I u CIDP existují varianty, které se liší od klasické formy. Variace se může týkat jednak průběhu (akutní nebo subakutní začátek), jednak distribuce neurologického deficitu. Multifokální získaná demyelinizační senzitivní a motorická neuropatie (MADSAM) je jednou z variant s výrazně asymetrickým nálezem. V EMG může být perzis tující blok vedení. Byla původně popsána jako multifokální demyelinizační neuropatie s perzistujícím blokem vedení (Lewisův-Sumnerův syndrom). Vzácnou variantou je samostatná senzitivní forma (někdy s protilátkami proti sulfatidům nebo GM1 gangliosidům).
Mezi varianty CIDP patří i současná přítomnost některých systémových onemocnění, která bývá asi u 10 % nemocných (tab. 7).
V dif. dg. je třeba vždy třeba pátrat po těchto systémových onemocněních, ale i po dosud skrytém maligním procesu (neuropatie jako paraneoplastické onemocnění). Ale naopak i diabetik může mít CIDP, která je chybně považována za diabetickou neuropatii! Dosud není jednoznačně prokázáno, zda i u CIDP se vyskytují samostatné axonální formy.
Déletrvající podávání kortikoidů je zatíženo řadou možných vedlejších účinků, proto je podáváme vždy v jednorázové ranní dávce a postupně alternujícím způsobem obden.
Pokud jsou kortikoidy bez efektu, používá se i u CIDP jiná imunoterapie jako IVIG, plazmaferéza i další imunosupresiva (azathioprin, cyclosporin A, cyklofosfamid a methotrexat). Při intermitentním podávání IVIG se dávky aplikují obvykle v intervalu 3–4 týdnů, což přibližně odpovídá poločasu imunoglobulinu.
Azathioprin se často využívá v kombinaci se steroidy, protože je možné jejich dávky snížit, má „steroid sparing effect“. Podává se v dávkách 2–3 mg/kg/d. Z nežádoucích účinků azathioprinu se může vyskytnout akutní idiosynkratická reakce („léková horečka“), dochází k ní během prvních několika dnů, je nezávislá na dávce a je indikací k vysazení. Dřeňový útlum a vzestup transamináz jsou závislé na dávce, vzácně může dojít i k cholestáze. Při léčbě je třeba sledovat krevní obraz a jaterní funkce.
Cyklosporin A se podává dle tíže onemocnění a klinického efektu v dávce 2,5–5 mg/kg/d a léčba se monitoruje podle sérových hladin. Optimální hladina pro CIDP nebyla stanovena, ale obvykle se nepřekračuje 200 µg/l. Při léčbě cyklosporinem je třeba sledovat jaterní a ledvinné funkce a TK.
Mezi vedlejší účinky cyklofosfamidu patří hlavně alopecie, dřeňový útlum a hemoragická cystitida. Doporučíme dostatečnou hydrataci, která může do určité míry zmenšit riziko hemoragické cystitidy, která se vyskytuje až u 40 % nemocných.
Prognóza je variabilní, mortalita se udává do 5 %, morbidita 10–20 % (neschopen chůze, upoután na vozík nebo lůžko), 10–20 % nemocných je neschopno práce, 60–75 % pracuje.
Pro diferenciální diagnózu ALS svědčí jednak centrální projevy, které jsou u ALS přítomné a při nejasnostech progrese během 3–6 měsíců, která u MMN nikdy nebývá.
Relativně samostatnou jednotkou je paraneoplastická senzitivní neuronopatie (gangliopatie), u které patologický proces je lokalizován v gangliích zadních kořenů míšních. Začíná symetricky na všech končetinách, jde o globální poruchu čití, ale většinou jsou více postižena silná vlákna (propriocepce a vibrace), což vede k senzitivní ataxii, která je často dominantním klinickým projevem. Při této deaferentaci s relativně zachovanou svalovou silou se vyskytují i mimovolní pseudoatetoidní pohyby, především na rukou, ale někdy i nohou. Mohou být i lehčí abnormity hlavových nervů jako diplopie, nystagmus, anizokorie, i poruchy paměti. Typické je chybění senzitivních nervových akčních potenciálů (SNAP) při EMG vyšetření a často bývají pozitivní protilátky anti-Hu. Nejčastěji je se vyskytuje u ca plic, někdy esofagu, ceka, ovaria nebo ledvin.
Méně častá je senzitivní neuronopatie bez souvislosti s maligním procesem, která se vyskytuje někdy po febrilním onemocnění léčeném antibiotiky a předpokládá se určitá souvislost.
Léčebně se u diabetické amyotrofie doporučují nyní intermitentní pulzy methylprednisolonu (např. 500 mg vždy 2 dny každé 2 týdny po dobu 1–3 měsíců), prednison v dávce 0,75 mg/kg/d nebo i intravenózní imunoglobulin v dávce 0,5 g/kg/d vždy 2 dny každé 2 týdny po dobu 1–3 měsíců. Tato terapie však vyžaduje ještě další ověření. Nezbytná je vždy kompenzace diabetu a symptomatická léčba bolesti.
V dif. dg. je třeba odlišit především radikulopatie u degenerativních změn páteře, které však obvykle postihují jen 1 nebo 2 kořeny a méně často dochází k atrofiím a denervačním projevům. Kromě toho i event. tumory nebo jiné strukturální léze. V diagnostice budou rozhodující zobrazovací metody (CT, MR).
Progrese může být pozvolná, ale i stupňovitá po dobu několika měsíců. Tento typ neuropatie je reverzibilní, ale úprava může být velmi pomalá a trvá řadu měsíců.
O autoimunitní patogenezi se z diabetických neuropatií uvažuje rovněž u torakolumbálních a multifokálních neuropatií.
Jde o autoimunitní reakci proti periferním nervům a uplatňují se jak buněčné, tak protilátkové imunologické abnormity. Aberantní odpově d ’ B buněk na glykolipidy nebo obdobné sloučeniny zůstává stále klíčem k patogeneze. Uvažuje se rovněž o patogenetické roli antiglykolipidových protilátek, které vznikají prostřednictvím molekulárních mimiker vlivem mikrobiálních oligosacharidů, především určitých řetězců Campylobacter jejuni. Imunitní mechanizmy jsou někdy spouštěny předchozí infekcí nebo jinými vlivy (tab. 1) a GBS jako postinfekční onemocnění se vyskytuje asi u 2/3 pacientů. Předpokládá se patogenetická souvislost mezi předchozí infekcí a imunitním mechanizmem neuropatie.
Tabulka 1: Infekce a další okolnosti předcházející rozvoj GBS
Virové infekce
– Cytomegalovirus
– Epsteina-Barrové virus (mononukleóza)
– HIV infekce
– Coxsackie
– Herpes simplex
– Influenza
– Virus hepatitidy A a C
– Ostatní (spalničky, příušnice, varicella-zoster)
Bakteriální infekce
– Campylobacter jejuni
– Lymeská borelióza
– Mycoplasma pneumoniae
– Escherichia colli
Systémové choroby
– Hodgkinova choroba
– Chronická lymfatická leukémie
– Systémové autoimunitní choroby
Ostatní vlivy
– Očkování
– Operace
– Epidurální anestezie
– Těhotenství
– Transplantace kostní dřeně
Nejběžnějším typem je akutní zánětlivá demyelinizační polyneuropatie (AIDP). Jde o multifokální zánětlivé demyelinizační postižení periferních nervů a míšních kořenů, která je charakterizována kromě segmentální demyelinizace různým stupněm lymfocytární infiltrace periferních nervů, především v proximálních a terminálních úsecích. U těžších forem dochází k sekundární axonální degeneraci. Poškození myelinové pochvy je zprostředkováno hlavně T buňkami, protilátkově zprostředkovaná imunitní porucha přispívá k poruše nervových vláken. Je přítomna také porucha hemato-likvorové bariéry, především v oblasti terminálního větvení a kořenů, která zřejmě zodpovídá za průnik bílkovin do likvoru.
Základní princip imunitní reakce: auto reaktivní T buňky rozpoznají specifický antigen, aktivované T buňky mohou přestoupit nervově-cévní bariéru a vniknout do periferního nervového systému. T buňky aktivují makrofágy, dochází k produkci cytokinů, uvolňování toxických mediátorů a rozvoji demyelinizace a axonální poruchy. Obdobně i protilátky mohou překročit nervově-cévní bariéru a přispívají k procesu demyelinizace i axonální lézi.
Depozita IgG a komplementu předcházejí vlastní demyelinizaci.
Rozvoji neurologických symptomů předchází (průměrně 14 dnů) často infekt dýchacích cest nebo gastroenteritida, někdy i jiné infekční choroby nebo operace. Z infekčních agens se často prokáže Campylobacter jejuni nebo Cytomegalovirus. V patogenezi se zřejmě uplatňuje zkřížená imunitní reakce – molekulární mimikry – podobnost bakteriálních a nervových antigenních epitop (např. společné antigeny Campylobacter jejuni a nervových vláken). Různé proteiny a glykoproteiny (bakterií, virů i vlastních buněk) vytvářejí různé antigeny a každý antigen obsahuje řadu epitopů (obr. 1). Jako epitop se označuje část antigenní molekuly, ke které se váže molekula protilátky. Bylo zjištěno, že specifický peptidový, karbohydrátový nebo lipidový epitop infekčního virového nebo bakteriálního agens má sekvence jako antigenní epitop myelinu, lipopolysacharidy těchto organizmů sdílí epitopy podobné gangliosidům periferních nervů. Tyto nálezy vedly k hypotéze že „molekulární mimikry“ představují imunopatogenetický mechanizmus léze periferních nervových vláken.Vlastní začátek je charakterizován poměrně rychlým rozvojem (během dnů) nejčastěji symetrické slabosti DK, časté jsou současně myalgie (bolesti bývají u 15–50 % pacientů), parestézie nebo i dysestézie. Obvykle dochází k pomalé ascendentní progresi (50–60 %) a šíření příznaků proximálně, na HK a hlavové nervy. N. facialis bývá postižen až v 50 %.
Onemocnění může ale začít i bulbárním syndromem s descendentním šířením. Progrese trvá obvykle dva, maximálně podle kritérií 4 týdny. K maximu postižení dojde během 7 dnů u 35 % nemocných, během 14 dnů u 70% a během 21 dnů u 84 %. Formy onemocnění jsou velmi variabilní. Lehká forma se projeví jen lehkou slabostí v DK, kde převažuje oslabená dorzální flexe nohou nebo slabost stehenního svalstva, u těžké formy může při ascendentní progresi vzniknout až kvadruplegie, mohou být postiženy i kaudální hlavové nervy, což se projeví bulbárním syndromem, oboustrannou lézí n. VII. (diplegia facialis) i dalších hlavových nervů. Nebezpečná je hlavně ventilační insuficience ze slabosti dýchacích svalů. Podle velkých souborů slabost končetin byla ve 100% – proximální převaha u 49 %, distální 27 %, n. facialis postižen u 53 %, pallanestezie u 59 %, hypalgézie u 22%, parestézie u 75 %, postižení sfinkterů u 32 % a postižení okohybných nervů u 13 % (kompletní oftalmoplegie může být ve 3–5 %). Průběh je afebrilní.
Mohou být i projevy autonomní dysfunkce (tachykardie, arytmie, hypertenze, posturální hypotenze), zejména u pacientů s těžkým motorickým deficitem. Nejčastější je hypertenze a anti hypertenziva je třeba podávat s vysokou opatrností. Nemocní jsou zvýšeně senzitivní na antihypertenziva a náhlá iatrogenní hypotenze může být příčinou i náhlé smrti! EKG změny se popisují až v 50 %.
V objektivním nálezu zjistíme kromě areflexie různě vyjádřený motorický deficit s proximální i distální převahou a nepříliš těžké poruchy čití. U těžších forem mohou být i psychické poruchy, klinické projevy léze CNS (mozečkové nebo lehké spastické příznaky) nebo známky demyelinizace na MR mozku.
Postižení se kvantifikuje podle Hughese do 7 základních stupňů:
0 – normální
1 – malé projevy
2 – schopen chůze > 5 m bez pomoci
3 – schopen chůze < 5 m s pomocí
4 – neschopen chůze (lůžko či vozík)
5 – asistovaná ventilace
6 – úmrtí
Diagnostika - EMG, likvor
V diagnostice má dominantní roli EMG – především kondukční studie, které jsou velmi senzitivní již v prvních dvou týdnech, kdy nález v likvoru může být ještě normální. Mezi nejcitlivější parametr u demyelinizačního typu patří prodloužené latence nebo chybění (ev. i abence) F odpovědi, následují snížené amplitudy CMAP, prodloužené distální motorické latence a známky kondukčního bloku (obr. 2, 3, 4). Elektrodiagnostické nálezy jsou důležité v časném stádiu k charakteristice typu GBS (demyelinizační nebo axonální). V prvních dvou týdnech se prokáže průměrně v 70 % demyelinizační typ léze, ve 23 % smíšený demyelinizační a axonální, pouze axonální ve 3 % a normální nález mohou mít 2 % nemocných (ale podle našeho souboru až 4 %). Závažný nález představují nestimulovatelné nervy, který se udává asi u 3 %. Pro senzitivní kondukční studie je charakteristické větší postižení SNAP na n. medianus a ulnaris nežli n. suralis na DK.
Typický je likvorový nález, kde je proteinocytologická disociace s množstvím bílkoviny obvykle nad 1 g/l, ale hodnoty mohou i vyšší. Během prvních dvou dnů však bývá zvýšená hodnota bílkovin pouze u 15 % nemocných, v první týdnu je již zvýšená u 66 % a ve druhém týdnu u 82 %. Počet buněčných elementů obvykle nepřevyšuje 10/mm 3 , ale asi u 5 % nemocných může být i lehká pleocytóza 10–20/mm 3 . Při výraznější pleocytóze je třeba myslet na boreliózu nebo infekci HIV.
Typický je likvorový nález, kde je proteinocytologická disociace s množstvím bílkoviny obvykle nad 1 g/l, ale hodnoty mohou i vyšší. Během prvních dvou dnů však bývá zvýšená hodnota bílkovin pouze u 15 % nemocných, v první týdnu je již zvýšená u 66 % a ve druhém týdnu u 82 %. Počet buněčných elementů obvykle nepřevyšuje 10/mm 3 , ale asi u 5 % nemocných může být i lehká pleocytóza 10–20/mm 3 . Při výraznější pleocytóze je třeba myslet na boreliózu nebo infekci HIV.
Typy
V nedávné době byly vyčleněny dva další typy s převážně axonálním postižením, jednak akutní motorická a senzitivní axonální neuropatie (AMSAN), která má smíšené senzitivní i motorické postižení, a jednak pouze motorická akutní motorická axonální neuropatie (AMAN). U akutní demyelinizační polyneuropatie (polyradikulopatie) AIDP je místem imunitní ataky Schwannova buňka, u AMSAN a AMAN je imunitní ataka směrována přímo na axolemu s depozity IgG a komplementu v oblasti Ranvierových zářezů. Makrofágy penetrují přes bazální laminu a atakují přímo vlastní axon. Axonální degenerace začíná především v oblasti nervových kořenů a později se rozšiřuje i na periferní nervy.AMAN často předchází průjmové onemocnění (zvýšené titry protilátek proti Campylobacter jejuni se nacházejí až v 67 %) nebo infekce dýchacích cest (protilátky proti Hemophilus influenzae ve 13 %), distální slabost převažuje nad proximální, hlavové nervy bývají postiženy asi u 25 % nemocných a respirační dysfunkce je méně častá nežli u GBS. Progrese je poměrně rychlá, průměrně 6 dnů a myotatické reflexy mohou být jen sníženy nebo i zachovány. Zlepšení nastává během 1–2 měsíců. IgG protilátky proti GM1 gan gliozidu se nacházejí ve 40–50 %.
Původní diagnostická kritéria NINDS (National Institute for Neurological Disorders and Stroke) lze považovat stále za užitečná, i když nezahrnují některé novější varianty:
• Hlavní – progredující slabost více nežli jedné končetiny, areflexie alespoň distálně
• Podporující – rychlá progrese, relativní symetrie, malé senzitivní projevy, postižení hlavových nervů, autonomní dysfunkce, afebrilní průběh, nález EMG a likvoru
• Zpochybňující – výrazná asymetrie, postižení sfinkterů, ostrá hranice čití a více jak 50 buněčných elementů na mm 3 v likvoru
• Průběh : po 2–4 týdnech se obvykle progrese zastaví, stav zůstává další 2–4 týdny stacionární a dochází k postupnému zlepšování (obr. 5).
Jako samostatné varianty se vyčleňují polyneuritis cranialis s oboustranným postižením n. VII. a minimálním nebo jen subklinickým nálezem na končetinách, někdy s parestéziemi. Motorické postižení a svalová slabost může být omezeno jen na oblast kraniobulbární (faryngo-cerviko-brachiální) nebo DK s obrazem areflektorické paraparézy s bolestí v zádech, která může připomínat míšní lézi nebo postižení kaudy. Existuje i pouze senzitivní postižení a akutní pandysautonomie.
Akutní senzitivní polyneuropatie (dysimunitní) má většinou asymetrický začátek, pozitivní i negativní senzitivní příznaky jsou vždy více a častěji v popředí nežli senzitivní ataxie.
Miller-Fisherův syndrom je další samostatná forma GBS a je charakterizován akutním začátkem trias oftalmoplegie, ataxie a areflexie, ale někdy mohou být postiženy i další hlavové nervy, především kaudální (bulbární syndrom). Může být i smíšený s klasickým GBS se slabostí končetinového, ale i dýchacího svalstva.
U GBS byla popsána přítomnost různých antiglykolipidových protilátek (GM1, GM1b, GD1b, GM2 aj.). Přestože je zatím nelze využít v diagnostice, lze podle nich rozčlenit GBS na další určité subtypy (obr. 6). Anti GM1 byly častěji přítomny u nemocných se známkami předchozí infekce Campylobacter jejuni a axonálních forem (AMSAN, AMAN), kde převažovala distální motorická léze bez postižení hlavových nervů. Protilátky anti GM2 byly častěji přítomny u infekce Cytomegalovirem, senzitivních lézí, s proximální motorickou převahou s postižením hlavových nervů a demyelinizačních forem (AIDP).
Diagnosticky významná je přítomnost anti GQ1b, která byly přítomna u Miller-Fisherova syndromu v některých studiích u více jak 90 % nemocných, ale byla nacházena rovněž u nemocných s GBS, kde byla přítomna oftalmoplegie.
Diferenciální diagnostika
V dif. dg. nutno odlišit jiné akutní neuropatie nebo stavy, které je mohou imitovat (tab. 2). Vzácně může přicházet u úvahu i polymyozitida, zejména když převažuje postižení proximálního svalstva. Rozvoj však bývá obvykle pomalejší, nebývá zde areflexie, jsou zvýšené hodnoty svalových enzymů, je většinou normální nález v likvoru a jiný typ EMG poruchy. Ve sporných případech pomůže svalová biopsie. Klinický obraz GBS se může vyskytovat také v souvislosti s některými lymfoproliferativními poruchami.Tabulka 2: Dif. dg. GBS – akutní neuropatie nebo stavy, které je mohou imitovat
– klíšťová encefalitida
– Lymeská borelióza
– vaskulitidy
– toxické neuropatie (botulismus,
– hexakarbony, arsen)
– myastenie
– leptospiróza (Weilova choroba)
– paraneoplastická senzitivní neuropatie (s protilátkami anti-Hu)
– porfyrie
– myoglobinurie (rabdomyolýza)
– elektrolytové poruchy
– periodické paralýzy
Průběh v kostce
Průběh GBS je typický: progrese trvá maximálně do 4 týdnů stav se pak stabilizuje a za další 2–4 týdny po zastavení pro grese dochází k postupnému zlepšování.Léčba
Základem každé terapie je dokonalá ošetřovatelská a často intenzivistická péče, často s nutností podpůrné nebo řízené ventilace, při dysfagii výživa nazogastrickou sondou. Nemocný by měl být hospitalizován na JIP nebo ARO.Velkými randomizovanými studiemi byl prokázán efekt dvou typů imunoterapie, které mohou ovlivnit průběh GBS: plazmaferézy a intravenózního imunoglobulinu (IVIG). S léčbou je třeba začít vždy co nejdříve, především u těžších forem, kdy nemocný není schopen samostatné chůze (stupeň 3 podle kvantifikace) nebo má obdobný neurologický deficit a u stavů se zřetelnou progresí. V úvahu bereme i rizikové faktory, které predikují horší prognózu (tab. 3). Vzhledem k jednodušší aplikaci a menším rizikům a vedlejším účinkům se preferuje jako první volna použití IVIG. Jednoznačně preferenční použití IVIG je u typu AMAN.
Tabulka 3: Rizikové faktory predikující horší prognózu GBS
– věk nad 40 let
– rychlý začátek a těžká progrese (stupeň 4 během prvního týdne)
– asistovaná ventilace
– těžká redukce amplitudy distálního CMAP, známky axonální degenerace
– průjem – průkaz infekce
Campylobacter jejuni
– absence léčby IVIG nebo plazmaferézou
IVIG se podává v celkové dávce 2 g/kg, bu d ’ po dobu 5 dnů 0,4 g/kg/d či 2 dny 1 g/kg/d.
Doporučená dávka IVIG byla stanovena empiricky a skutečná optimální terapeutická dávka není známa. Ně kteří autoři preferují schéma s rychlejším podáním celé dávky během 2 dnů, především u mladých nemocných s normálními renálními a kardiovaskulárními funkcemi, ale rychlost infuze by neměla překročit 200 ml/hod. Předpokládají, že rychlé dosažení vysoké koncentrace Ig v séru má lepší terapeutický efekt. Naopak jiní autoři preferují pomalejší 5denní schéma pro menší riziko vedlejších účinků. Pomalá rychlost infuze se doporučuje především u starších nemocných a nemocných s kardiovaskulárními poruchami. Vzestup tělesné tekutiny může vést k městnavé srdeční slabosti. Po aplikaci IVIG dochází také k vzestupu sérové viskozity, což může vést k tromboembolickým poruchám. Zvýšené riziko je u nemocných s již preexistujícím zvýšením viskozity (hypergamaglobulinémie nebo hypercholesterolémie).
Schéma s podáváním vyšších dávek pouze během dvou dnů sice vede k rychlejšímu nástupu efektu, ale může být spojeno s větším výskytem vedlejších reakcí i komplikací – především vaskulárních. Většina autorů proto preferuje 5denní schéma. Před aplikací IVIG se doporučuje vyšetřit ledvinné funkce a u nemocných s alergickou anamnézou hodnoty IgA.
Mechanizmus účinku imunoglobulinu není přesně znám, předpokládá se zásah na několika úrovních:
• blokáda, případně modulace exprese a afinity Fc receptorů v monocytomakrofágovém systému
• interference s vazbou imunitních komplexů
• blíže nespecifikovaná podpora supresorové funkce T lymfocytů a snížení činnosti B lymfocytů
• aktivita antiidiotypová, která ne utralizuje vlastní autoimunitní protilátky nebo blokuje jejich produkci
• inhibice působení a syntézy cytokinů
• neutralizace superantigenů a patogenů
• snížení aktivity komplementu
• zásah do mechanizmu apoptózy lym focytů
Obecně vedlejší účinky jsou převážně mírné a jen ojediněle závažné (tab. 4).
Druhým typem imunoterapie je plazmaferéza. Aplikuje se obvykle obden po dobu 7–14 dnů, většinou obden 5–7x. Randomizované studie prokázaly prakticky stejný efekt plazmaferézy i IVIG. Naopak nebyly prokázány lepší efekty při kombinaci obou typů terapie (nejprve plazmaferéza následována IVIG). V některých případech, kde nedojde k efektu, především zastavení progrese po IVIG, se však doporučuje v odstupu 2–3 týdnů aplikovat i plazmaferézu (toto doporučení však nebylo potvrzeno studiemi, jde jen o kazuistická sdělení). Nikdy však neaplikujeme plazmaferézu bezprostředně po léčbě IVIG. Jednak bychom aplikovaný a drahý imunoglobulin z oběhu opět odstranili, jednak pozitivní léčebný efekt IVIG může ještě několik dnů dobíhat po ukončení aplikace. Po infuzi IVIG sérové hladiny IgG stoupají pětinásobně, během dalších 72 hodin klesnou na 50 % a k normálním původním hladinám se vrací během 3–4 týdnů.
Nezbytným doplňkem terapie je symptomatická léčba, především u bolestí.
Podávání samotných kortikoidů není indikováno, jejich účinnost nebyla u GBS nikdy prokázána. V současné době byla ukončena studie o současném podávání IVIG a methylprednisolonu, ale ani tato kombinace nepřináší významně lepší výsledky nežli samotný IVIG.
Asi u 10 % nemocných se mohou ve 2.–3. týdnu vyskytnout relapsy, které někdy vyžadují přeléčení jednotlivou dávkou IVIG nebo plazmaferézou.
Přestože uvedená imunomodulační terapie přinesla značný pokrok do léčby GBS, udává se, že ovlivní příznivě průběh jen u 60 % nemocných (13).
Prognóza je poměrně příznivá, k funkční úpravě dochází asi u 85 % nemocných během 6–12 měsíců. Po těžkých formách. může zůstat i reziduální deficit, rezidua po 1 roce mohou být až u 15 % nemocných. Mortalita se udává 2–5 % v závislosti na kvalitě komplexní péče.
Chronická zánětlivá demyelinizační polyneuropatie (CIDP)
Od GBS se odlišuje především průběhem a závažnější prognózou. Základní kritéria viz tab. 5. Rozvíjí se pomaleji, progrese trvá více jak 8 týdnů, ale obvykle několik měsíců. Asi v 16 % může však být i relativně akutní nebo subakutní začátek. Postižení může být i asymetrické. Svalová slabost obvykle není provázena atrofiemi nebo fascikulacemi. Může však být slabost i šíjového svalstva. Postižení hlavových nervů se udává asi v 16 %, ale nebývá většinou těžké. Jde především o n. facialis (postižení se udává v 10–15 %), okohybné nervy, kde se porucha může manifestovat jen jako diplopie a jen vzácně dochází k postižení bulbárních svalů. Mnoho pacientů s CIDP má výrazné senzitivní potíže. Asi u 20 % může jít o bolestivé dysestezie.Může být přítomen tremor, senzitivní ataxie i fokální začátek. Oproti GBS se nevyskytují významné předchozí provokační vlivy, i když vzhledem k pomalému rozvoji může být obtížné je identifikovat.
CIDP se může vyskytovat rovněž u dětí. Začátek je často rychlejší a manifestuje se hlavně poruchou chůze.
Asi u 5 % nemocných s CIDP mohou být klinické známky postižení také centrálního nervového systému. Mohou být projevy spasticity, hyperreflexie nebo ataxie, takže se někdy klinický obraz může podobat i roztroušené skleróze mozkomíšní. Asi 20 % nemocných může mít abnormity pouze zjištěné na MR mozku.
Pro diagnózu je stěžejní elektrodiagnostické vyšetření, které by mělo splňovat daná kritéria pro demyelinizační postižení (viz tab. 5). Pro dia gnózu CIDP by měla být přítomna 3 ze 4 daných kritérií.
Někteří autoři však doporučují i „měkčí“ kritéria, kterými sice mohou zachytit více nemocných, ale jejich specificita se tím snižuje:
Alespoň dva abnormní parametry na dvou nervech:
1. snížení rychlosti vedení motorických vláken ve dvou nebo více nervech (< 90 % dolního limitu pokud amplituda CMAP > 50 % dolní normy, ev. < 80 % pokud amplituda CMAP < 50 %)
2. prodloužená DML na 2 nebo více nervech (>115 % horního limitu normy je-li amplituda CMAP normální, nebo > 125 % je-li amplituda CMAP menší nežli dolní limit)
3. částečný blok vedení nebo časová disperze na jednom nebo více motorických nervech je definován jako poměr proximální a distální amplitudy CMAP < 0,7
4. absence nebo prodloužení latence F vlny alespoň na dvou nervech (> 125 % horního limitu normy)
V likvoru bývá obdobně jako u GBS proteinocytologická disociace. Na MR se mohou někdy prokázat známky ztluštění míšních kořenů (obr. 7). Zobrazovací metody však nepřispívají k diagnostice, jejich role jen při případné dif. dg.
Biopticky se prokázaly jednak známky demyelinizace, jednak intersticiální a perivaskulární a endoneurální infiltrace lymfocyty a makrofágy.
Průběh je asi v 50 % postupně progredující, ve 33 % recidivující (s relapsy a remisemi) a u zbývající části monofázický se stacionárním stavem (bez další progrese). Formy s akutním začátkem se prakticky nedají odlišit od GBS, rozlišení přinese až další průběh.
I u CIDP existují varianty, které se liší od klasické formy. Variace se může týkat jednak průběhu (akutní nebo subakutní začátek), jednak distribuce neurologického deficitu. Multifokální získaná demyelinizační senzitivní a motorická neuropatie (MADSAM) je jednou z variant s výrazně asymetrickým nálezem. V EMG může být perzis tující blok vedení. Byla původně popsána jako multifokální demyelinizační neuropatie s perzistujícím blokem vedení (Lewisův-Sumnerův syndrom). Vzácnou variantou je samostatná senzitivní forma (někdy s protilátkami proti sulfatidům nebo GM1 gangliosidům).
Mezi varianty CIDP patří i současná přítomnost některých systémových onemocnění, která bývá asi u 10 % nemocných (tab. 7).
V dif. dg. je třeba vždy třeba pátrat po těchto systémových onemocněních, ale i po dosud skrytém maligním procesu (neuropatie jako paraneoplastické onemocnění). Ale naopak i diabetik může mít CIDP, která je chybně považována za diabetickou neuropatii! Dosud není jednoznačně prokázáno, zda i u CIDP se vyskytují samostatné axonální formy.
Tabulka 7: Možnosti současného výskytu chorob u CIDP
– Lymfom
– Osteosklerotický myelom
– Monoklonální gamapatie
– Chronická aktivní hepatitis
– Zánětlivé choroby střevní
– Systémové imunopatologické stavy („kolagenózy“)
– Transplantace kostní dřeně a orgánové transplantace
– CNS demyelinizace
– HIV infekce
– Nefrotický syndrom
– Diabetes mellitus
– Hereditární neuropatie
– Tyreotoxikóza
Léčba
CIDP reaguje příznivě na některou imunoterapii jen asi u 2/3 nemocných. Léčba se obvykle zahajuje kortikoidy. U těžších forem volíme na počátku i.v. methylprednisolon, 1 g po dobu 5 dnů. Prednison se doporučuje v iniciální dávce 1–1,5 mg/kg/den a pokud je onemocnění steroid responzivní, přibližně 90 % nemocných se zlepší během 2 měsíců. Vysoké denní dávky je třeba podávat až do nástupu zlepšení, které se však může dostavit až za 2–3 měsíce. Pak teprve přecházíme na alternující režim obden a dávky pomalu snižujeme. Dávkování na obdenní režim měníme postupně, např. 1 den 80 mg, druhý den 40 mg apod. Maximální zlepšení dosáhne asi 50 % pacientů během 6 měsíců, 95 % pacientů během 1 roku.Déletrvající podávání kortikoidů je zatíženo řadou možných vedlejších účinků, proto je podáváme vždy v jednorázové ranní dávce a postupně alternujícím způsobem obden.
Hlavní rizika a vedlejší účinky orálních steroidů
• peptický vřed – preventivně se doporučují antacida (např. Anacid, Maalox, Rennie) a antagonisté histaminu na H 2 -receptorech (např. cimetidin, ranitidin, famotidin). Riziko peptického vředu se podle současných sdělení zdá poměrně malé. Většinou k němu došlo při kombinaci prednisonu s nesteroidními analgetiky antirevmatiky.
• hypokalémie
• glukózová intolerance – zejména u pacientů s latentním diabetem nebo rodinnou anamnézou diabetu.
• hypertenze – je doporučována dieta s nízkým obsahem natria a někdy také antihypertonika.
• osteopenie a osteoporóza – všichni nemocní, kteří užívají prednison déle nežli 6 měsíců v dávce 7,5 mg a více, jsou ohroženi vznikem osteoporózy. Při plánování této léčby je vhodné vyšetření hustoty kostního minerálu. Úbytek kostní hmoty je přímo úměrný kumulativní dávce. Při vysokém dávkování až 30 % trabekulární kosti může být ztraceno během prvních měsíců terapie. Ztráta kostní hmoty je výrazná nejen u postmenopauzálních žen a imobilizovaných nemocných, ale také u dětí. V prevenci se doporučuje kalcium 1–1,5 g/d a rovněž vitamin D 400 IU/d. Pouze u některých jsou indikovány bifosfonáty. Důležitá je i fyzikální terapie a pohybová aktivita podle tolerance nemocného vzhledem ke svalové slabosti, která je nejen prevencí osteoporózy, ale také steroidní myopatie.
• přírůstek na váze , cushingoidní vzhled – doporučuje se tzv. steroidní dieta: nízkokalorická, s nízkým obsahem soli, cukrů a přiměřeným množstvím proteinů. Tato dieta rovněž minimalizuje hypertenzi a hyperglykémii.
• katarakta a glaukom
• myopatie – u steroidní myopatie svalové enzymy a EMG zůstávají často normální, vyskytuje se častěji u žen, hlavně při dávce prednisonu nad 30 mg/d. Je velká individuální náchylnost ke steroidní myopatii a její rozvoj může být jak během týdnů tak i měsíců. Ke zlepšení dochází izometrickými cviky, které lze doporučit i preventivně.
Pokud jsou kortikoidy bez efektu, používá se i u CIDP jiná imunoterapie jako IVIG, plazmaferéza i další imunosupresiva (azathioprin, cyclosporin A, cyklofosfamid a methotrexat). Při intermitentním podávání IVIG se dávky aplikují obvykle v intervalu 3–4 týdnů, což přibližně odpovídá poločasu imunoglobulinu.
Azathioprin se často využívá v kombinaci se steroidy, protože je možné jejich dávky snížit, má „steroid sparing effect“. Podává se v dávkách 2–3 mg/kg/d. Z nežádoucích účinků azathioprinu se může vyskytnout akutní idiosynkratická reakce („léková horečka“), dochází k ní během prvních několika dnů, je nezávislá na dávce a je indikací k vysazení. Dřeňový útlum a vzestup transamináz jsou závislé na dávce, vzácně může dojít i k cholestáze. Při léčbě je třeba sledovat krevní obraz a jaterní funkce.
Cyklosporin A se podává dle tíže onemocnění a klinického efektu v dávce 2,5–5 mg/kg/d a léčba se monitoruje podle sérových hladin. Optimální hladina pro CIDP nebyla stanovena, ale obvykle se nepřekračuje 200 µg/l. Při léčbě cyklosporinem je třeba sledovat jaterní a ledvinné funkce a TK.
Mezi vedlejší účinky cyklofosfamidu patří hlavně alopecie, dřeňový útlum a hemoragická cystitida. Doporučíme dostatečnou hydrataci, která může do určité míry zmenšit riziko hemoragické cystitidy, která se vyskytuje až u 40 % nemocných.
Prognóza je variabilní, mortalita se udává do 5 %, morbidita 10–20 % (neschopen chůze, upoután na vozík nebo lůžko), 10–20 % nemocných je neschopno práce, 60–75 % pracuje.
Distální motorická axonální neuropatie
Mezi chronické imunoneuropatie patří také vzácná distální motorická axonální neuropatie (označovaná také jako distální syndrom periferního motoneuronu – distal lower motor neuron syndrome). Začíná ve věku mezi 16–62 lety, iniciální projevy jsou obvykle na rukou, postižení je asymetrické s distální převahou motorické slabosti. Jen málokdy bývají fascikulace a čití je normální. Choroba je zvolna progresivní a dochází k atrofiím především opět na rukou. Elektrofyziologicky jde o asymetrickou axonální lézi, někdy s mírnými projevy demyelinizace, ale nikdy není blok vedení. Bývají přítomny IgM protilátky proti GM1 gangliosidu. Oproti ALS chybí známky postižení centrálního motoneuronu, progrese je pomalejší. Likvor bývá většinou normální. V léčbě se používá cyklofosfamid, někdy IVIG, ale léčebné efekty jsou varia bilní.Multifokální motorická neuropatie
Multifokální motorická neuropatie (MMN) patří mezi samostatné, ale vzácné jednotky (často jsou přítomné protilátky IgM proti GM1 gangliosidu). Jde o pomalu progredující motorickou lézi v distribuci jednotlivých periferních nervů, častěji na HK, někdy s fascikulacemi a krampy, takže může připomínat i ALS. Frekvence je mnohem nižší, přibližně na 50–100 nemocných s ALS je 1 nemocný s MMN a častěji se vyskytuje u mužů. Časté je hlavně postižení v distribuci n. radialis s oslabením extenze třeba jen některého prstu nebo i extenze zápěstí, následuje medianus, ulnaris, peroneus a musculocutaneus. Slabost je často výraznější než by odpovídalo svalové atrofii. Pro dg. je dominantní EMG, které prokáže demyelinizační charakter léze často s perzistujícím blokem vedení i mimo místa obvyklých kompresí u úžinových syndromů. Likvorový nález je normální. Histologicky se zjistily kromě demyelinizačních úseků i buněčné infiltráty. Oproti CIDP není u MMN příznivý efekt kortikoidů. Lékem volby je IVIG a zkouší se rovněž cyklofosfamid bu d ’ v denních dávkách 100–150 mg nebo periodické intravenózní cykly 1–3 g/m 2 . Výsledky jsou však poměrně variabilní. Plazmaferéza není indikována.Pro diferenciální diagnózu ALS svědčí jednak centrální projevy, které jsou u ALS přítomné a při nejasnostech progrese během 3–6 měsíců, která u MMN nikdy nebývá.
Paraneoplastické neuropatie
Neuropatie u nemocných s karcinomy vznikají jednak přímou infiltrací periferních nervů (např. leukemické infiltráty) nebo jako paraneoplastický projev (především u malobuněčného ca plic, žaludku, střeva, střeva, urogenitálního traktu, prostaty a gynekologických tumorů). Paraneoplastické syndromy nejsou důsledkem invaze maligního procesu do příslušných tkání (jako u metastáz), ale jsou způsobeny nepřímým, vzdáleným efektem, jehož etiopatogeneze není dosud objasněna. Uvažují se vlivy imunitní – autoimunitní odpově d ’ namířená proti společným antigenním komponentám (8, 18), které jsou exprimovány tumorem i postiženou částí nervového systému, (tvorba specifických antineuronálních protilátek), toxické – sekrece neurotoxických substancí nebo i možnost virové nebo retrovirové infekce. Paraneoplastické neuropatie mohou manifestaci maligního onemocnění předcházet o řadu měsíců až let, bývají bu d ’ převážně nebo zcela senzitivního typu, ale někdy mohou mít i charakter CIDP, amyotrofické neuropatie brachiálního plexu nebo i AIDP (u Hodgkinovy choroby). U některých lze prokázat neuronálně specifické protilátky (anti Hu).Relativně samostatnou jednotkou je paraneoplastická senzitivní neuronopatie (gangliopatie), u které patologický proces je lokalizován v gangliích zadních kořenů míšních. Začíná symetricky na všech končetinách, jde o globální poruchu čití, ale většinou jsou více postižena silná vlákna (propriocepce a vibrace), což vede k senzitivní ataxii, která je často dominantním klinickým projevem. Při této deaferentaci s relativně zachovanou svalovou silou se vyskytují i mimovolní pseudoatetoidní pohyby, především na rukou, ale někdy i nohou. Mohou být i lehčí abnormity hlavových nervů jako diplopie, nystagmus, anizokorie, i poruchy paměti. Typické je chybění senzitivních nervových akčních potenciálů (SNAP) při EMG vyšetření a často bývají pozitivní protilátky anti-Hu. Nejčastěji je se vyskytuje u ca plic, někdy esofagu, ceka, ovaria nebo ledvin.
Méně častá je senzitivní neuronopatie bez souvislosti s maligním procesem, která se vyskytuje někdy po febrilním onemocnění léčeném antibiotiky a předpokládá se určitá souvislost.
Proximální diabetická amyotrofie
V současné době je možno mezi dys imunitní neuropatie zařadit i proximální diabetickou amyotrofii (nazývanou také diabetická lumbosakrální radikuloplexopatie, někdy Bruns-Garlandův syndrom). Vyskytuje se více u DM 1. typu (1,1 %) nežli 2. typu (0,3 %) a hlavně v 6. a 7. dekádě. Nezáleží na době trvání diabetu. Bývá jednostranná i oboustranná, ale vždy asymetrická a silně bolestivá. Imponuje jako femorální neuropatie, ale postižení je širší, jde o radikulo-plexo-neuropatii. Někdy začíná primárním kořenovým postižením (především L2–4) s dalším teritoriálním šířením proximálně, distálně i kontralaterálně. Vzniká akutně v průběhu několika dnů i subakutně (týdnů), může být provázena subkompenzací diabetu nebo ztrátou hmotnosti, která může i předcházet klinickou manifestaci. Začíná typicky bolestmi, někdy tupými, jindy ostrými, palčivými v oblasti kyčle, stehna, někdy i v kříži. Parestézie nebo dysestézie bývají méně vyjádřeny. Klinicky kromě bolestí se poměrně rychle rozvíjejí atrofie a svalová slabost, obvykle během několika dnů ale i týdnů. Postihuje nejvíce svalstvo lumbálního pletence, iliopsoas, stehenní svalstvo, kvadriceps, adduktory, ale i gluteální svaly a někdy i oblast bérce, extenzory na přední straně. EMG prokáže axonální lézi s denervačním syndromem v postižených svalech, ale i para spinálně a většinou i známky koexistující distální symetrické, převážně senzitivní, polyneuropatie. Bioptické nálezy ze senzitivních větví na stehně prokázaly asymetrickou ztrátu axonů mezi fascikly, těžké ischemické poškození nervu, okluzi perineurálních cév ale i perivaskulární, perineurální a subperineurální zánětlivé infiltrace s mononukleáry a axonální degenerací, endoneurální zánětlivý proces s B a T lymfocyty a makrofágy a známky nekrotizující lymfocytární i ne-nekrotizující epineurální vaskulitidy (obr. 8). V etiopatogenezi této formy neuropatie se proto dnes uvažuje o primární nebo superponované imunologické poruše a nekrotizující vaskulitidě.Léčebně se u diabetické amyotrofie doporučují nyní intermitentní pulzy methylprednisolonu (např. 500 mg vždy 2 dny každé 2 týdny po dobu 1–3 měsíců), prednison v dávce 0,75 mg/kg/d nebo i intravenózní imunoglobulin v dávce 0,5 g/kg/d vždy 2 dny každé 2 týdny po dobu 1–3 měsíců. Tato terapie však vyžaduje ještě další ověření. Nezbytná je vždy kompenzace diabetu a symptomatická léčba bolesti.
V dif. dg. je třeba odlišit především radikulopatie u degenerativních změn páteře, které však obvykle postihují jen 1 nebo 2 kořeny a méně často dochází k atrofiím a denervačním projevům. Kromě toho i event. tumory nebo jiné strukturální léze. V diagnostice budou rozhodující zobrazovací metody (CT, MR).
Progrese může být pozvolná, ale i stupňovitá po dobu několika měsíců. Tento typ neuropatie je reverzibilní, ale úprava může být velmi pomalá a trvá řadu měsíců.
O autoimunitní patogenezi se z diabetických neuropatií uvažuje rovněž u torakolumbálních a multifokálních neuropatií.
Závěr
Získané autoimunitní neuropatie jsou v posledních letech středem odborného zájmu různých klinických i laboratorních pracovišť. Představují významnou skupinu, protože jsou poměrně časté a léčitelné. S dalším rozvojem poznatků imunopatogeneze lze očekávat i další pokroky v léčbě.Tabulka 4: Vedlejší účinky IVIG (11)
Systémové reakce – bývají závislé na dávce a rychlosti infuze bolesti hlavy, nauzea, teploty, myalgie, pocit krátkého dechu, bolesti nebo tlak na hrudi, únava po infuzi, nechutenství
Kardiovaskulární reakce
hypertenze, tachykardie, srdeční selhání, povrchní tromboflebitidy, tromboembolické příhody
Renální komplikace
akutní renální tubulární nekróza, akutní renální selhání (převážně u nemocných s již existující ledvinnou poruchou, např. diabetickou nefropatií)
Neurologické komplikace
migréna, aseptická meningitida, cerebrovaskulární příhody, reverzibilní encefalopatie
Hypersenzitivita
anafylaktické reakce (především u nemocných s IgA deficitem), hemolytická anémie, neutropenie, lymfopenie, artritida (imunitní komplexy)
Kožní reakce
urtika, pruritus, petechie
Laboratorní projevy
hyponatremie, zvýšení FW, snížení hemoglobinu, zvýšení jaterních enzymů
Tabulka 5: Diagnostická kritéria pro CIDP
Potvrzující klinická
– progredující nebo relabující svalová slabost déle nežli 2 měsíce
– symetrická proximální a distální slabost HK nebo DK
– hypo- nebo areflexie
Potvrzující laboratorní
– elektrodiagnostická kritéria (viz tab. 6)
– celková bílkovina v likvoru > 0,45 g/l a počet elementů < 10/ mm3
– biopsie n. suralis se známkami demyelinizace a remyelinizace včetně úbytku myelinizovaných vláken
Vylučovací kritéria
– známky systémové choroby nebo riziko toxických vlivů
– rodinná anamnéza neuropatie
– nález nervové biopsie, který není kompatibilní s dg. CIDP
Diagnostické kategorie
A. Definitivní – splňuje všechna kritéria
B. Pravděpodobná – splňuje klinická potvrzující i vylučující a 2 ze 3 laboratorních kritérií
C. Možná – splňuje klinická potvrzující i vylučující a 1 ze 3 laboratorních kritérií
Tabulka 6: Elektrodiagnostická kritéria CIDP
1. snížení rychlosti vedení motorických vláken ve dvou nebo více nervech (< 80 % dolního limitu pokud amplituda CMAP > 80 % dolní normy, ev. < 70 % pokud amplituda CMAP < 80 %)
2. částečný blok vedení nebo časová disperze na jednom nebo více motorických nervech
3. prodloužená DML na dvou nebo více nervech (> 125 % horního limitu normy je-li amplituda CMAP > 80 %, nebo > 150 % je-li amplituda CMAP < 80 %)
4. absence nebo prodloužení latence F vlny alespoň na dvou nervech (> 125 % horního limitu normy je-li amplituda CMAP > 80 %, nebo > 150 % je-li amplituda CMAP < 80 %)
CMAP = sumační svalový (motorický) akční potenciál – „compound muscle (motor) action potential“
DML = distální motorická latence
Obrázkové přílohy:
Obr. 1: Schéma virus – antigen – epitopy.
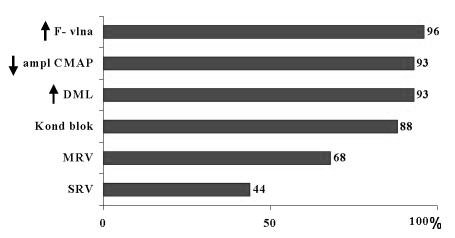
Obr. 2: Senzitivita kondukční studie v prvních dvou týdnech u AIDP. CMAP – sumační svalový akční potenciál; DML – distální motorická latence; MCV – motorická rychlost vedení; SCV – senzitivní rychlost vedení.
Obr. 3: Schéma fokální demyelinizace a vzniku bloku vedení.
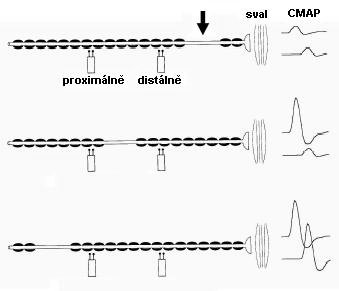
Obr. 4: Kondukční studie. Vlevo normální nález, CMAP stejné velikosti při stimulaci distálně i proximálně, vpravo blok vedení a časová disperze při proximální stimulaci.
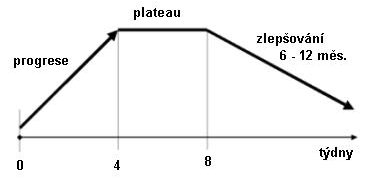
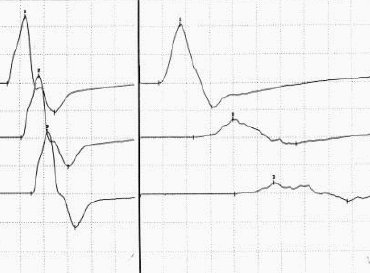
Obr. 5: Schéma průběhu GBS.

Obr. 6: Diagram subtypů GBS podle typu postižení, přítomnosti protilátek a předcházející infekce.

Obr. 7: MR u CIDP – postupně sagitální T2, T1 a T1 s kontrastem. Je patrno ztluštění kaudy a difuzní enhancement.
Zdroj:
Z. Ambler, J. Piťha
Převzato z
Kolektiv autorů, Neurologie 2003. Praha: Triton 2003.
http://www.tridistri.cz


